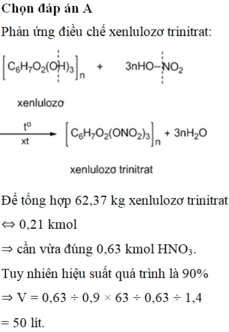
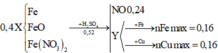
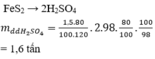1) Từ 120 kg FeS2 có thể điều chế được tối đa bao nhiêu lít dung dịch H2SO4 98% (d = 1.84 g/ml). Biết hiệu suất của cả quá trình là 40%.
2) Cho 11g hỗn hợp Al, Fe tan hoàn toàn trong H2SO4 đặc nóng thu được 4.032 lít hỗn hợp 2 khí H2S, SO2 có tỉ khối hơi so với H2 là 24.5%. Tính khối lượng của mỗi kim loại trong hỗn hợp.